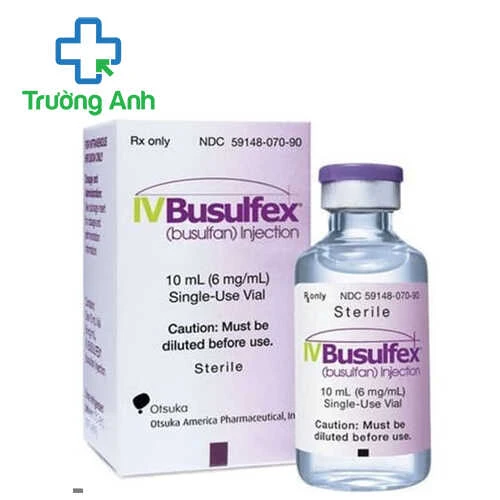
IV Busulfex (Busulfan) Injection - Thuốc điều trị bệnh bạch cầu hiệu quả của Mỹ
Liên hệ
Chính sách khuyến mãi
Dược sỹ tư vấn 24/7.
Khách hàng lấy sỉ, sll vui lòng liên hệ call/Zalo để được cập nhật giá
Sản phẩm chính hãng, cam kết chất lượng.
Kiểm tra hàng trước khi thanh toán.
Chuyển phát toàn quốc: 25.000đ/đơn (dưới 2kg). Đơn thuê ship ngoài khách tự thanh toán phí ship
Thông tin dược phẩm
Nhà sản xuất:
Số đăng ký:
VN2-614-17
Hoạt chất:
Hoạt chất:
Busulfan
Xuất xứ:
USA
Dạng bào chế:
Dung dịch tiêm truyền
Đóng gói:
Hộp lớp x 8 hộp nhỏ x 1 ống 10ml
Hạn sử dụng:
30 tháng
Video
IV Busulfex (Busulfan) Injection là thuốc gì?
- IV Busulfex (Busulfan) Injection là thuốc dùng kết hợp với thuốc khác điều trị tạo máu ở bệnh bạch cầu tủy bào mạn tính. IV Busulfex (Busulfan) Injection được sản xuất bởi Patheon Manufaturing Services LLC.
Thành phần của IV Busulfex (Busulfan) Injection
- Busulfan................60mg/10ml.
Dạng bào chế
- Dung dịch tiêm truyền tĩnh mạch.
Công dụng – Chỉ định của IV Busulfex (Busulfan) Injection
- Busulfex (busulfan) Injection được chỉ định dùng phối hợp với cyclophosphamid trong phác đồ điều kiện hóa trước khi ghép tế bào gốc tạo máu đồng loại cho các bệnh bạch cầu tủy bào mạn tính.
Chống chỉ định của IV Busulfex (Busulfan) Injection
Liều dùng – Cách dùng của IV Busulfex (Busulfan) Injection
- Cách dùng: Thuốc dùng theo đường tiêm truyền.
- Liều dùng:
- Khi BUSULFEX được dùng như là một phần trong phác đồ điều kiện hóa BuCy (busulfan – cyclophosphamid) trước khi thay thế tế bào gốc tủy xương hoặc tế bào gốc máu ngoại vi, liều dùng khuyến cáo như sau:
- Người lớn (Bucy2): Liều thường dùng ở người lớn là 0,8 mg/kg thể trọng lý tưởng hoặc thể trọng thực tế, bất cứ cái nào thấp hơn, dùng mỗi 6 giờ trong 4 ngày (tổng là 16 liều). Đối với bệnh nhân béo phì, hoặc béo phì trầm trọng, liều BUSULFEX được cho dùng dựa trên thể trọng lý tưởng đã điều chỉnh.
- Thể trọng lý tưởng (IBW) được tính như sau (chiều cao bằng cm, và cân nặng bằng kg):
- IBW (kg; nam giới) = 50 + 0,91 x (chiều cao bằng cm – 152);
- IBW (kg; nữ giới) = 45 + 0,91 x (chiều cao bằng cm – 152).
- Cân nặng lý tưởng đã điều chỉnh (AIBW) được tính như sau: AIBW = IBW + 0,25 x (cân nặng thực tế – IBW).
- Cyclophosphamid được dùng mỗi ngày trong 2 ngày, liều dùng 60 mg/kg truyền trong 1 giờ bắt đầu vào ngày ghép tủy xương (BMT) – 3, không sớm hơn 6 giờ sau liều BUSULFEX thứ 16.
- Sự thanh thải BUSULFEX được dự báo tốt nhất khi liều dùng BUSULFEX được dựa trên cân nặng lý tưởng đã điều chỉnh. Liều dùng BUSULFEX được dựa trên cân nặng thực tế, cân nặng lý tưởng hoặc các yếu tố khác có thể tạo ra sự khác biệt quan trọng trong việc thanh thải BUSULFEX Injection ở những bệnh nhân gầy, bình thường và béo phì.
- BUSULFEX được truyền tĩnh mạch qua ca-tê-te tĩnh mạch trung tâm, truyền 2 giờ mỗi 6 giờ trong 4 ngày liên tiếp với tổng là 16 liều. Tất cả các bệnh nhân cần được dùng trước với phenytoin vì busulfan được biết là có đi qua hàng rào máu não và gây ra cơn động kinh.
- Phenytoin giảm 15% AUC của busulfan trong huyết tương. Việc sử dụng các thuốc chống co giật khác có thể tạo ra AUC của busulfan trong huyết tương cao hơn và tăng nguy cơ tắc tĩnh mạch ở gan (VOD) hoặc cơn động kinh. Trong trường hợp phải dùng các thuốc chống co giật khác, cần kiểm soát lượng busulfan có trong huyết tương (xem phần Tương tác). Các thuốc chống nôn cần được dùng trước liều BUSULFEX đầu tiên và được tiếp tục theo kế hoạch cố định trong suốt quá trình dùng BUSULFEX. Khi có thể, nên xem xét việc kiểm soát dược động học để tăng thêm mục tiêu điều trị.
- Trẻ em: Hiệu quả của BUSULFEX trong điều trị bệnh bạch cầu tủy bào mạn tính (CML) chưa được nghiên cứu một cách chuyên biệt ở trẻ em. Xem thêm thông tin ở mục Sử dụng ở các đối tượng đặc biệt – Sử dụng ở trẻ em.
- Điều chỉnh liều dựa trên kiểm soát thuốc điều trị: Hướng dẫn đo AUC của liều busulfan số 1 (xem Lấy mẫu máu để xác định AUC), và công thức để điều chỉnh cho các liều tiếp sau để đạt được mục tiêu AUC mong muốn (1125 µM·phút), như sau:
- Liều điều chỉnh (mg) = Liều thực tế (mg) x AUC mục tiêu (µM·phút)/AUC thực tế (µM·phút)
- Ví dụ, nếu bệnh nhân dùng một liều 11 mg busulfan và nếu đáp ứng AUC đo được là 800 µM·phút, cho AUC mục tiêu là 1125 µM·phút, liều mục tiêu (theo mg) sẽ là:
- Mg liều = 11 mg x 1125 µM·phút / 800 µM·phút = 15,5 mg
- Việc điều chỉnh liều BUSULFEX có thể dùng công thức và hướng dẫn sau:
- Lấy mẫu máu để xác định AUC: Việc tính toán AUC (µM·phút) dựa trên việc lấy mẫu máu tại các thời điểm sau:
- Cho liều 1: 2 giờ (kết thúc truyền), 4 giờ và 6 giờ (ngay lập tức trước khi cho dùng tiếp BUSULFEX theo kế hoạch). Cần ghi lại thời gian lấy mẫu thực tế.
- Cho các liều không phải liều 1: trước khi truyền (mức cơ sở), 2 giờ (kết thúc truyền), 4 giờ và 6 giờ (ngay lập tức trước khi cho dùng tiếp BUSULFEX theo kế hoạch).
- Việc tính toán AUC dựa trên ít hơn 3 mẫu cụ thể nêu trên có thể cho kết quả AUC không chính xác.
- Với mỗi mẫu máu, lấy 1 đến 3 mL máu vào ống Vacutainer tráng heparin (natri heparin hoặc lithi heparin). Mẫu máu nên được để ngay trong khay đá ướt sau khi lấy và nên được ly tâm (ở 4oC) trong vòng 1 giờ. Huyết tương, thu được trong ống bảo quản lạnh thích hợp, được làm đông lạnh ngay lập tức ở -20oC. Tất cả các mẫu huyết tương được gửi trong trạng thái đông lạnh (ví dụ như đá khô) tới phòng thí nghiệm để xác định nồng độ busulfan huyết tương.
- Tính toán AUC: Việc tính toán AUC của BUSULFEX có thể dùng hướng dẫn sau và công thức dược động học tiêu chuẩn thích hợp:
- Tính toán AUC liều 1: AUCvô cực = AUC0-6 giờ + AUCngoại suy, trong đó AUC0-6 giờ được ước tính dựa trên công thức tuyến hình thang và AUCngoại suy có thể tính được bằng cách lấy tỉ số nồng độ busulfan lúc 6 giờ và hằng số tỉ lệ kết thúc thải trừ λz. λz phải được tính toán dựa từ pha kết thúc thải trừ của nồng độ busulfan so với đường cong thời gian. Cần giả định một nồng độ “0” trước khi dùng busulfan, và dùng nó để tính toán AUC.
- Nếu đánh giá AUC tiếp sau liều 1, trạng thái-ổn định của AUCss (AUC0-6 giờ) được ước lượng từ vùng giữa các nồng độ lúc 2 giờ, 4 giờ và 6 giờ dùng công thức tuyến hình thang.
- Hướng dẫn dùng thuốc và lấy mẫu máu để theo dõi thuốc điều trị: Nên dùng bộ dây truyền có thể tích khoang dư tối thiểu (1-3 mL) để truyền thuốc để chắc chắn rằng đã truyền chính xác toàn bộ liều thuốc đã kê đơn và để chắc chắn lấy mẫu máu chính xác để kiểm soát thuốc điều trị và điều chỉnh liều.
- Bắt đầu truyền dung dịch thuốc và ghi lại chính xác thời gian bắt đầu truyền BUSULFEX. Lấy mẫu máu từ một tĩnh mạch ngoại biên để tránh làm tạp nhiễm với thuốc đang truyền. Nếu mẫu máu được lấy trực tiếp từ ca-tê-te tĩnh mạch trung tâm (CVC) đang truyền, KHÔNG ĐƯỢC LẤY MẪU MÁU TRONG KHI ĐANG TRUYỀN THUỐC để chắc chắn rằng mẫu máu khi kết thúc truyền không bị tạp nhiễm với bất kỳ lượng thuốc dư nào. Sau khi truyền xong (2 giờ), rút ống truyền và dội rửa dây CVC với 5 mL dung dịch nước muối sinh lý trước khi lấy mẫu máu khi kết thúc truyền từ cổng CVC. Lấy các mẫu máu từ một cổng khác với cổng CVC để truyền BUSULFEX. Khi ghi lại thời gian ngừng truyền BUSULFEX, không tính thời gian cần để dội rửa bên trong ca-tê-te. Loại bỏ ống truyền sau khi kết thúc 2-giờ tiêm truyền.
- Lấy mẫu máu để xác định AUC: Việc tính toán AUC (µM·phút) dựa trên việc lấy mẫu máu tại các thời điểm sau:
- Ví dụ, nếu bệnh nhân dùng một liều 11 mg busulfan và nếu đáp ứng AUC đo được là 800 µM·phút, cho AUC mục tiêu là 1125 µM·phút, liều mục tiêu (theo mg) sẽ là:
Lưu ý và thận trọng khi sử dụng IV Busulfex (Busulfan) Injection
- Nên sử dụng BUSULFEX dưới sự giám sát của bác sĩ có kinh nghiệm trong việc ghép tế bào gốc tạo máu. Việc xử trí các biến chứng khi tiêm truyền thuốc chỉ có thể thực hiện được khi có đầy đủ và sẵn sàng các phương tiện chẩn đoán và điều trị.
- Các cảnh báo sau gắn liền với các tác dụng sinh lý khác nhau của BUSULFEX trong việc ghép đồng loại.
- Huyết học: Hậu quả nghiêm trọng thường xuyên nhất của việc điều trị với BUSULFEX ở liều khuyến cáo là ức chế tủy bào hoàn toàn, xảy ra ở tất cả các bệnh nhân. Giảm bạch cầu hạt, giảm tiểu cầu, thiếu máu nghiêm trọng, hoặc giảm kết hợp các yếu tố này có thể xảy ra. Xét nghiệm công thức máu thường xuyên, bao gồm sự khác nhau của công thức bạch cầu, và lượng tiểu cầu nên được kiểm soát trong quá trình điều trị và đến khi đạt được sự hồi phục. Lượng bạch cầu trung tính giảm xuống dưới 0,5×109/L ở khoảng 4 ngày sau khi ghép trên 100% bệnh nhân được điều trị trong thử nghiệm lâm sàng với BUSULFEX. Lượng bạch cầu được hồi phục vào khoảng 13 ngày sau ghép đồng loại khi G-CSF dự phòng được sử dụng ở phần lớn số bệnh nhân. Giảm lượng tiểu cầu (<25.000/mm3 hoặc cần truyền tiểu cầu) xảy ra ở khoảng 5-6 ngày trên 98% số bệnh nhân. Thiếu máu (hemoglobin <8,0 g/dL) xảy ra trên 69% số bệnh nhân. Nên sử dụng điều trị kháng sinh và cung cấp tiểu cầu và hồng cầu khi có chỉ định y khoa.
- Thần kinh: Đã có báo cáo về các cơn động kinh ở bệnh nhân dùng busulfan đường uống liều cao mà liều này tạo ra nồng độ thuốc trong huyết tương tương tự như nồng độ đạt được theo như liều dùng khuyến cáo của BUSULFEX. Bất chấp điều trị dự phòng với phenytoin, một cơn động kinh (1/42 bệnh nhân) đã được báo cáo trong thử nghiệm lâm sàng ghép tự thân có dùng BUSULFEX. Cơn này xảy ra trong khi dùng cyclophosphamid trong phác đồ điều kiện hóa, 36 giờ sau liều BUSULFEX cuối cùng. Nên bắt đầu trị liệu phòng ngừa chống co giật trước khi điều trị với BUSULFEX. Cần lưu ý khi cho dùng BUSULFEX với liều khuyến cáo ở những bệnh nhân có tiền sử rối loạn động kinh hoặc có chấn thương ở đầu hoặc bệnh nhân đang dùng các thuốc khác có khả năng gây động kinh.
- Gan: Các tài liệu hiện thời cho rằng giá trị diện tích dưới đường cong (AUC) của busulfan cao (>1.500 µM·phút) có thể liên quan với tăng nguy cơ phát triển bệnh tắc tĩnh mạch ở gan (HVOD). Những bệnh nhân đã dùng liệu pháp phóng xạ trước đó, nhiều hơn hoặc tương đương 3 đợt hóa trị liệu, hoặc đã có ghép tế bào gốc trước đó có tăng nguy cơ phát triển HVOD ở liều BUSULFEX và điều trị khuyến cáo. Dựa trên kiểm tra lâm sàng và các phát hiện xét nghiệm, bệnh tắc tĩnh mạch ở gan được chẩn đoán trên 8% (5/61) bệnh nhân đã điều trị với BUSULFEX trong ghép đồng loại, bị chết 2/5 ca (40%), và số tử vong toàn bộ từ HVOD trong toàn bộ nghiên cứu là 2/61 (3%). Ba trong số năm bệnh nhân được chẩn đoán HVOD khi kiểm tra hồi cứu cho thấy phù hợp với tiêu chí của Jone. Tỉ lệ HVOD được báo cáo trong tài liệu từ các thử nghiệm ngẫu nhiên, thử nghiệm có đối chứng là 7,7%-12%.
- Tim mạch: Biểu hiện chèn ép tim đã được báo cáo ở những bệnh nhân nhi mắc thalassemia (8/400 hoặc 2% trong một đợt) có dùng liều cao busulfan đường uống và cyclophosphamid trong phác đồ điều kiện hóa cho ghép tế bào gốc tạo máu. Sáu trong số tám trẻ đã tử vong và hai trẻ được cứu nhờ chọc màng ngoài tim nhanh. Đau bụng và nôn thường xuất hiện trước khi có chèn ép ở phần lớn bệnh nhân. Không có bệnh nhân nào được điều trị bởi BUSULFEX Injection trong thử nghiệm lâm sàng có biểu hiện chèn ép tim.
- Phổi: Hiếm gặp loạn sản phế quản phổi với xơ hóa phổi, nhưng là biến chứng nghiêm trọng sau điều trị busulfan mãn tính. Khởi phát của các triệu chứng thường là 4 năm sau điều trị (trong khoảng 4 tháng đến 10 năm).
- Khả năng gây ung thư, khả năng gây đột biến, suy giảm khả năng sinh sản: Busulfan là một tác nhân gây đột biến và gây thay đổi nhiễm sắc thể. Trong các thí nghiệm in vitro nó gây đột biến ở Salmonella typhimurium và Drosophila melanogaster. Sự bất thường về nhiễm sắc thể gây ra bởi busulfan đã được báo cáo in vivo (chuột cống, chuột nhắt, chuột đồng, và người) và in vitro (loài gặm nhấm, tế bào người). Busulfan tiêm truyền tĩnh mạch (48 mg/kg được dùng mỗi hai tuần của 12 mg/kg, hoặc 30% của tổng liều BUSULFEX dựa trên cơ sở mg/m2) có tăng tỉ lệ u nang tuyến ức hoặc u nang buồng trứng ở chuột nhắt. Bốn ca bạch cầu cấp tính xuất hiện trong số 19 bệnh nhân đã bị giảm toàn thể huyết cầu trong tổng số 243 bệnh nhân của nghiên cứu có kết hợp busulfan như là một trị liệu bổ trợ tiếp sau phẫu thuật cắt bỏ ung thư biểu mô phế quản. Sự xuất hiện lâm sàng của bệnh bạch cầu được thấy sau 5-8 năm sau khi uống busulfan. Busulfan được cho là chất gây ung thư trên người.
- Tác dụng kiềm chế buồng trứng và mãn kinh thường xuất hiện ở phụ nữ tiền mãn kinh khi đang dùng busulfan liều thấp lâu dài để điều trị bệnh bạch cầu tủy bào mãn tính. Busulfan làm tiêu dịch noãn bào của chuột cống cái. Busulfan gây mất khả năng sinh sản ở chuột cống đực và chuột đồng. Hiện tượng mất khả năng sinh sản, không có tinh trùng, teo tinh hoàn ở bệnh nhân nam giới cũng đã được báo cáo.
- Dung môi DMA cũng có thể gây suy giảm khả năng sinh sản. Dùng một liều DMA hàng ngày là 0,45 g/kg/ngày cho chuột cống trong vòng 9 ngày (tương đương 44% liều hàng ngày của DMA có trong liều khuyến cáo của BUSULFEX trên cơ sở mg/m2) gây giảm đáng kể sự sinh tinh trùng ở chuột cống. Dùng một liều đơn dưới da 2,2 g/kg (27% của tổng liều DMA có trong BUSULFEX trên cơ sở mg/m2) trong bốn ngày sau khi thụ tinh đã chấm dứt hiện tượng mang thai của 100% số chuột đồng làm thử nghiệm.
- Huyết học: Ở liều dùng khuyến cáo của BUSULFEX Injection, việc ức chế tủy bào hoàn toàn là phổ biến và có biểu hiện là giảm bạch cầu trung tính, giảm lượng tiểu cầu, thiếu máu, hoặc kết hợp các biểu hiện này. Cần kiểm soát các dấu hiệu nhiễm trùng khu trú hoặc nhiễm trùng toàn thân hoặc chảy máu ở bệnh nhân. Cần đánh giá thường xuyên tình trạng huyết học của bệnh nhân.
- Thông tin cho bệnh nhân: Cần giải thích cho bệnh nhân về việc tăng nguy cơ có một khối u ác tính thứ hai.
- Kết quả xét nghiệm: Cần theo dõi hàng ngày bằng tổng phân tích máu ở những bệnh nhân dùng BUSULFEX, bao gồm số lượng tiểu cầu và sự khác nhau về số lượng, cho đến khi đã ghép xong. Để phát hiện sự độc hại cho gan, mà sự độc hại này có thể báo trước sự khởi phát bệnh tắc tĩnh mạch ở gan, cần đánh giá hàng ngày transaminase huyết tương, alkalin phosphatase, và bilirubin cho đến ngày BMT +28.
- Sử dụng ở các đối tượng đặc biệt:
- Trẻ em: Hiệu quả của BUSULFEX trong điều trị bệnh bạch cầu tủy bào mãn tính (CML) ở trẻ em chưa được nghiên cứu một cách chuyên biệt.
- Một nghiên cứu mở, không có đối chứng để đánh giá dược động học của BUSULFEX ở 24 bệnh nhân nhi dùng BUSULFEX trong phác đồ điều kiện hóa trước khi ghép tế bào gốc tạo máu cho các bệnh huyết học ác tính (N=15) hoặc không ác tính (N=9). Bệnh nhân có độ tuổi trong khoảng 5 tháng đến 16 tuổi (trung bình 3 tuổi). Cho liều BUSULFEX với mục đích đạt được diện tích dưới đường cong (AUC) là 900-1350 µM·phút với liều khởi đầu là 0,8 mg/kg hoặc 1,0 mg/kg (dựa trên ABW) nếu bệnh nhân tương ứng > 4 hoặc ≤ 4 tuổi. Liều dùng được điều chỉnh dựa trên nồng độ huyết tương sau khi hoàn thành liều 1.
- Bệnh nhân dùng các liều BUSULFEX mỗi 6 giờ và truyền trong 2 giờ trong 4 ngày cho tổng 16 liều, tiếp theo cho dùng cyclophosphamid 50 mg/kg ngày một lần dùng trong 4 ngày. Sau một ngày nghỉ, cho truyền tế bào gốc tạo máu. Tất cả bệnh nhân đều được cho dùng phenytoin để phòng ngừa cơn động kinh. AUC mục tiêu (900-1350 ± 5% µMphút) đạt được ở liều 1 trong số 71% (17/24) bệnh nhân. Kiểm tra trạng thái dược động học ổn định được tiến hành ở liều 9 và 13. Nồng độ BUSULFEX nằm trong khoảng mục tiêu ở 21 trong số 23 bệnh nhân.
- Tất cả 24 bệnh nhân đều có giảm bạch cầu trung tính (lượng bạch cầu trung tính tuyệt đối < 0,5×109/L) và giảm lượng tiểu cầu (truyền tiểu cầu hoặc lượng tiểu cầu < 20.000/mm3). 79% (19/24) bệnh nhân có giảm lympho bào (lượng lympho bào < 0,1×109). Ở 23 bệnh nhân, lượng bạch cầu trung tính tuyệt đối (ANC) phục hồi > 0,5×109/L (thời gian trung bình để phục hồi = ngày BMT + 13; khoảng thời gian hồi phục = ngày BMT +9 tới +22). Một bệnh nhân tử vong trong ngày +20 đã không phục hồi tới lượng bạch cầu trung tính tuyệt đối (ANC) > 0,5×109/L. Bốn (17%) bệnh nhân đã tử vong trong khi nghiên cứu. Hai bệnh nhân đã tử vong trong vòng 28 ngày sau khi ghép, một bệnh nhân do viêm phổi và hội chứng rò mao mạch, và bệnh nhân kia do viêm phổi và bệnh tắc tĩnh mạch. Hai bệnh nhân tử vong trước ngày thứ 100; một do bệnh tiến triển và một do suy giảm đa cơ quan.
- Phản ứng có hại được báo cáo ở tất cả 24 bệnh nhân trong giai đoạn nghiên cứu (ngày BMT-10 đến ngày BMT+28) hoặc giai đoạn theo dõi sau nghiên cứu (ngày +29 đến +100). Những phản ứng này bao gồm nôn (100%), buồn nôn (83%), viêm miệng (79%), bệnh tắc tĩnh mạch ở gan (HVOD) (21%), bệnh thải ghép (GVHD) (25%), và viêm phổi (21%
- Người già: Năm trong số sáu bệnh nhân được điều trị trong thử nghiệm BUSULFEX là hơn 55 tuổi (trong khoảng 57-64 tuổi). Tất cả đều đạt được sự loại bỏ tủy bào và ghép vào được.
- Giới tính, chủng tộc: Chưa có nghiên cứu phù hợp về việc điều chỉnh liều BUSULFEX dựa trên giới tính và chủng tộc.
- Suy giảm chức năng thận: BUSULFEX chưa được nghiên cứu trên bệnh nhân có suy giảm chức năng thận.
- Suy giảm chức năng gan: BUSULFEX chưa được cho dùng ở bệnh nhân có suy giảm chức năng gan.
- Khác: Busulfan có thể gây chứng loạn sản tế bào ở rất nhiều cơ quan. Các bất thường về tế bào học như có tế bào khổng lồ, nhân có nhiều thể nhiễm sắc đã được báo cáo trong các hạch bạch huyết, tụy, tuyến giáp, tuyến thượng thận, gan, phổi và tủy xương. Chứng loạn sản tế bào này có thể đủ nghiêm trọng để gây ra khó khăn trong việc đọc kết quả kiểm tra tế bào bong ở phổi, bàng quang, vú và tử cung.
Sử dụng thuốc cho phụ nữ có thai và cho con bú
- Thời kỳ mang thai:
- Busulfan có thể gây ảnh hưởng xấu tới phôi thai khi cho dùng ở phụ nữ mang thai. Busulfan sinh ra các thay đổi gây quái thai ở con của chuột nhắt, chuột cống và thỏ khi cho dùng thuốc này ở thời kỳ mang thai. Các dị tật và bất thường bao gồm sự thay đổi đáng kể ở hệ cơ xương, cân nặng cơ thể, và kích cỡ. Ở chuột cống mang thai, busulfan gây ra sự vô sinh ở cả con đực và con cái của chúng do không có tế bào gốc ở tinh hoàn và buồng trứng. Dung môi, DMA, cũng có thể gây hại cho phôi thai khi được cho dùng ở phụ nữ mang thai. Ở chuột cống, cho dùng các liều DMA 400 mg/kg/ngày (khoảng 40% liều hàng ngày của DMA có trong liều BUSULFEX trên cơ sở mg/m2) trong thời kỳ phát triển các cơ quan cũng gây ra những bất thường đáng kể về phát triển. Những bất thường nổi bật bao gồm phù toàn thân, hở vòm họng, bất thường về cột sống, bất thường về xương sườn, và các bất thường nghiêm trọng về các mạch ở tim. Chưa có các nghiên cứu phù hợp và có đối chứng tốt của busulfan hoặc DMA ở phụ nữ mang thai. Nếu BUSULFEX được sử dụng ở phụ nữ đang mang thai, hoặc nếu bệnh nhân có thai khi đang dùng BUSULFEX, nên báo cho bệnh nhân biết được mối nguy hiểm tiềm tàng với phôi thai. Cần thông báo cho những phụ nữ trong độ tuổi có khả năng sinh đẻ tránh có thai trong khi dùng thuốc này.
- Thời kỳ cho con bú:
- Chưa biết liệu thuốc này có tiết qua sữa người mẹ hay không. Vì nhiều thuốc được tiết qua sữa mẹ và vì busulfan có khả năng sinh ra khối u trên người và động vật nghiên cứu, nên cần ra quyết định ngừng cho con bú hay ngừng dùng thuốc, có tính đến tầm quan trọng của thuốc với người mẹ.
Sử dụng cho người lái xe và vận hành máy móc
- Không phù hợp dùng.
Tương tác thuốc
- Itraconazol giảm mức thanh thải busulfan lên tới 25%, và có thể tạo ra một AUC >1500 µM·phút ở một số bệnh nhân. Tất cả các thuốc fluconazol, và odansetron 5-HT3 chống nôn (Zofran) và granisetron (Kytril) đều đã được dùng với BUSULFEX.
- Phenytoin tăng mức thanh thải busulfan lên 15% hoặc hơn, có thể do có cảm ứng với glutathion-S-transferase. Do dược động học của BUSULFEX được nghiên cứu ở bệnh nhân có điều trị với phenytoin, mức thanh thải của BUSULFEX ở liều khuyến cáo có thể thấp hơn và có mức AUC cao hơn ở bệnh nhân không điều trị với phenytoin. Do busulfan được thải trừ từ cơ thể thông qua việc kết hợp với glutathion, việc dùng acetaminophen trước (<72 giờ) hoặc đồng thời với BUSULFEX có thể gây ra giảm thanh thải busulfan dựa trên đặc tính đã biết là acetaminophen làm giảm nồng độ glutathion trong máu và các mô.
Quên liều thuốc và cách xử trí
- Hiện chưa có báo cáo.
Quá liều và cách xử trí
- Chưa biết được thuốc giải độc BUSULFEX khác hơn là ghép tế bào gốc tạo máu. Khi không ghép tế bào gốc tạo máu được, liều khuyến cáo cho BUSULFEX có thể gây ra sự quá liều busulfan. Tác dụng gây độc chính là sự giảm sản/giảm tái tạo tủy xương hoàn toàn và giảm toàn thể huyết cầu, nhưng hệ thần kinh trung ương, gan, phổi và đường tiêu hóa cũng có thể bị ảnh hưởng. Cần kiểm soát tình trạng máu chặt chẽ và có các biện pháp hỗ trợ tích cực theo chỉ định y khoa. Đã có báo cáo về sự sống sót sau khi dùng liều đơn 140 mg Myleran (busulfan) Tablets ở một trẻ 4 tuổi nặng 18kg. Một trẻ 2 tuổi vô tình uống busulfan nhiều hơn liều bình thường (2,1 mg/kg; tổng liều 23,3 mg/kg) trước khi ghép tủy xương theo kế hoạch mà không có di chứng. Liều cấp tính 2,4 g gây chết một bé trai 10 tuổi. Có một báo cáo cho thấy busulfan có thể bị thẩm tách, do vậy sự thẩm tách nên được xem xét trong trường hợp quá liều. Busulfan được chuyển hóa bằng cách kết hợp với glutathion, do vậy nên xem xét khi cho dùng cùng glutathion.
Quy cách đóng gói
- Hộp lớp x 8 hộp nhỏ x 1 ống 10ml
Bảo quản
- Bảo quản thuốc nơi khô ráo, tránh ánh sáng mạnh.
Hạn sử dụng
- 30 tháng kể từ ngày sản xuất.
Nhà sản xuất IV Busulfex (Busulfan) Injection
- Patheon Manufaturing Services LLC
Sản phẩm tương tự
Câu hỏi thường gặp
Tuyên bố miễn trừ trách nhiệm:
Mục tiêu của chúng tôi là cung cấp cho bạn thông tin hiện tại và phù hợp nhất. Tuy nhiên, vì thuốc tương tác khác nhau ở mỗi người, chúng tôi không thể đảm bảo rằng thông tin này bao gồm tất cả các tương tác có thể. Thông tin này không thay thế cho lời khuyên y tế. Luôn luôn nói chuyện với nhà cung cấp dịch vụ chăm sóc sức khỏe của bạn về các tương tác có thể xảy ra với tất cả các loại thuốc theo toa, vitamin, thảo dược và chất bổ sung, và các loại thuốc không kê đơn mà bạn đang dùng.
Sản phẩm liên quan
Sản phẩm cùng hãng
Bình luận
Bạn hãy là người đầu tiên nhận xét về sản phẩm này