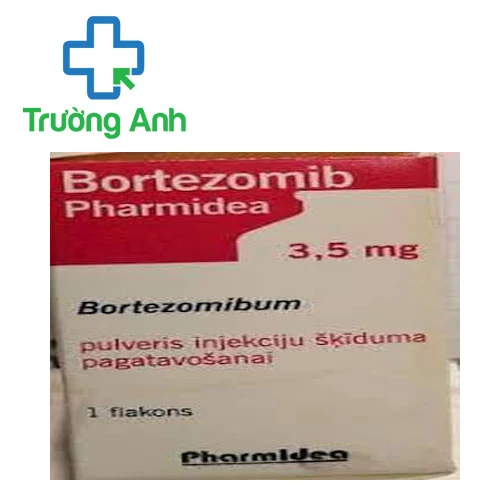
Bortezomib Pharmidea - Thuốc điều trị đa u tủy hiệu quả
Chính sách khuyến mãi
Dược sỹ tư vấn 24/7.
Khách hàng lấy sỉ, sll vui lòng liên hệ call/Zalo để được cập nhật giá
Sản phẩm chính hãng, cam kết chất lượng.
Kiểm tra hàng trước khi thanh toán.
Chuyển phát toàn quốc: 25.000đ/đơn (dưới 2kg). Đơn thuê ship ngoài khách tự thanh toán phí ship
Thông tin dược phẩm
Video
Bortezomib Pharmidea là thuốc gì?
-
Bortezomib Pharmidea là thuốc được chỉ định điều trị đa u tủy, ung thư hạch tế bào lớp áo, cảm ứng cho bệnh nhân trưởng thành bị đa u tủy đã có ít nhất liệu pháp điều trị trước đó hoặc không phù hợp cấy ghép tủy. Thuốc Bortezomib Pharmidea là thuốc được các bác sĩ khuyên dùng cho bệnh nhân ung thư có tác dụng, hiệu quả rõ rệt.
Thành phần của thuốc Bortezomib Pharmidea
-
Hoạt chất gồm: Bortezomib 3,5 mg.
-
Tá dược: Manitol 35 mg, nitrogen vừa đủ.
Dạng bào chế thuốc Bortezomib Pharmidea
-
Thuốc bột đông khô pha dung dịch tiêm
Công dụng - chỉ định của thuốc Bortezomib Pharmidea
-
Chỉ định:
-
Thuốc Bortezomib Pharmidea được chỉ định như một liệu pháp đơn độc hoặc kết hợp với pegylated liposomal doxorubicin hoặc dexamethason được chỉ định điều trị đa u tủy tiến triển ở bệnh nhân trưởng thành, đã nhận ít nhất 1 liệu pháp điều trị trước đó và đã trải qua hoặc không phù hợp với cấy ghép tủy.
-
-
Công dụng:
-
Bortezomib Pharmidea kết hợp với mephalan và prednison được chỉ định điều trị cho bệnh nhân trưởng thành trước đó chưa được điều trị đa u tủy, không phù hợp hóa trị liệu liều cao với cây ghép tủy.
-
Bortezomib Pharmidea kết hợp với dexamethason, hoặc với dexamethason và thalidomid, được chỉ định điều trị cảm ứng cho bệnh nhân trưởng thành bị đa u tủy chưa được điều trị trước đó, mà đủ điều kiện cho hóa trị liệu liều cao với cây ghép tủy.
-
Chống chỉ định của thuốc Bortezomib PharmideaBortezomib Pharmidea
-
Quá mẫn với bortezomib, boron hoac bất cứ thành phần nào của thuốc.
-
Bệnh màng ngoài tim và bệnh phổi thâm nhiễm lan tỏa cấp tính.
-
Khi thuốc được sử dụng kết hợp với các thuốc khác, tham khảo tóm tắt đặc tính sản phẩm của các thuốc đó cho chống chỉ định bổ sung.
Liều dùng - Cách dùng của thuốc Bortezomib PharmideaBortezomib Pharmidea
-
Liều dùng:
-
Đơn trị liệu: Bortezomib Pharmidea được dùng qua đường tiêm tĩnh mạch hoặc dưới da tại mức liều khuyến cáo 1,3 mg/m² diện tích bề mặt cơ thể 2 lần mỗi tuần cho 2 tuần vào các ngày 1, 4, 8, và 11 trong một chu kỳ điều trị 21 ngày. Khoảng thời gian 3 tuần được coi là 1 chu kỳ điều trị. Bệnh nhân được khuyến cáo điều trị 2 chu kỳ bortezomib sau khi xác định đáp ứng hoàn toàn.
-
Điều chỉnh liều trong khi điều trị và bắt đầu điều trị lại cho đơn trị liệu: Điều trị với bortezomib phải ngừng lại khi bắt bất kỳ đầu độc tính không thuộc huyết học mức độ 3 hoặc bất kỳ độc tính huyết học mức độ 4, ngoại trừ bệnh thần kinh. Khi các triệu chứng của độc tính được xử trí, điều trị với bortezomib có thể được bắt đầu lại tại mức liều giảm 25%
-
Điều trị kết hợp với pegylated liposomal doxorubicin: Bortezomib được sử dụng qua đường tĩnh mạch hoặc tiêm dưới da tại liều khuyến cáo 1,3 mg/m² diện tích bề mặt cơ thể 2 lần mỗi tuần trong 2 tuần vào các ngày 1,4,8 và 11 trong chu kỳ điều trị 21 ngày.
-
Điều trị kết hợp với dexamethason: Bortezomib được dùng thông qua tiêm tĩnh mạch hoặc tiêm dưới da tại liều khuyến cáo 1,3 mg/m² diện tích bề mặt cơ thể 2 lần mỗi tuần trong 2 tuần vào các ngày 1, 4. 8, và 11 trong 21 ngày của chu ky điều trị. Thời gian 3 tuần được xem như 1 chu ky điều trị. Khoảng cách giữa các liều điều trị của bortezomib nên ít nhất là 72 giờ
-
-
Cách dùng: thuốc được sử dụng dưới dạng tiêm tĩnh mạch 3-5 giây qua ống thông IV ngoại vi hoặc trung tâm, sau đó rửa bằng dung dịch natri clorid 0,9% để tiêm.
Lưu ý đặc biệt và thận trọng khi sử dụng thuốc Bortezomib PharmideaBortezomib Pharmidea
- Khi thuốc được sử dụng kết hợp với các thuốc khác, tham khảo tóm tắt đặc tính sản phẩm của các thuốc đó cho chống chỉ định bổ sung.
-
Thuốc Bortezomib Pharmidea được hấp thu tốt tuy nhiên cũng sẽ xảy ra một số tác dụng phụ thường nhẹ và trong thời gian ngắn
Sử dụng cho phụ nữ có thai và đang cho con bú
-
Phụ nữ có thai:
-
Bệnh nhân nên được khuyên dùng biện pháp tránh thai hiệu quả trong thời gian điều trị bằng bortezomib.
-
-
Phụ nữ cho con bú:
-
Người ta không biết liệu bortezomib có được bài tiết qua sữa mẹ không. Vì nhiều thuốc được bài tiết qua sữa mẹ và vì nguy cơ cao các phản ứng phụ nghiêm trọng cho bé nuôi qua sữa mẹ. Bà mẹ nên được khuyên tránh cho con bú trong lúc điều trị bortezomib.
-
Sử dụng cho người lái xe và vận hành máy móc
-
Do bortezomib có thể gây ra hạ huyết áp, mệt mới, choáng váng, ngất xỉu, nhìn đôi hoặc nhìn mờ do đó bệnh nhân nên thận trọng khi lái xe hoặc vận hành máy móc
Tác dụng phụ của thuốc Bortezomib Pharmidea
-
Tóm tắt các thử nghiệm lâm sàng của Bortezomib Pharmidea IV ở bệnh nhân đa u tủy tái phát / chịu lửa: Tính an toàn và hiệu quả của Bortezomib Pharmidea đã được đánh giá trong 3 nghiên cứu với liều khuyến cáo là 1,3 mg / m 2 . Các nghiên cứu này bao gồm một nghiên cứu so sánh ngẫu nhiên pha 3 với dexamethasone trên 669 bệnh nhân bị đa u tủy tái phát hoặc khó chữa đã được điều trị 1-3 dòng trước đó (M34101-039); một nghiên cứu đa trung tâm một nhánh, nhãn mở, pha 2 trên 202 bệnh nhân đã nhận được ít nhất 2 liệu pháp trước đó và chứng minh sự tiến triển của bệnh trong liệu pháp gần đây nhất của họ (M34100-025); và một nghiên cứu lâm sàng đáp ứng liều pha 2 trong bệnh đa u tủy tái phát cho những bệnh nhân đã tiến triển hoặc tái phát trong hoặc sau liệu pháp điều trị bậc 1 với Bortezomib Pharmidea 1 mg / m 2hoặc 1,3 mg / m 2 (M34100-024).
-
Tóm tắt các thử nghiệm lâm sàng của Bortezomib Pharmidea IV so với SC ở bệnh nhân Đa u tủy tái phát: Tính an toàn và hiệu quả của Bortezomib Pharmidea SC đã được đánh giá trong 1 nghiên cứu pha 3 ở liều khuyến cáo 1,3 mg / m 2 . Đây là một nghiên cứu ngẫu nhiên, so sánh giữa Bortezomib Pharmidea IV so với SC trên 222 bệnh nhân đa u tủy tái phát.
-
Mặc dù nhìn chung, dữ liệu an toàn tương tự nhau đối với nhóm điều trị IV và SC, bảng sau đây nêu rõ sự khác biệt lớn hơn 10% về tỷ lệ phản ứng có hại của thuốc giữa 2 nhóm điều trị.
-
Bệnh nhân sử dụng Bortezomib Pharmidea SC so với tiêm tĩnh mạch có tỷ lệ phản ứng có hại của thuốc cấp cứu khi điều trị thấp hơn 13% đối với độc tính cấp độ 3 trở lên (tương ứng là 57% so với 70%) và tỷ lệ ngừng sử dụng Bortezomib thấp hơn 5% Pharmidea (22% so với 27%). Tỷ lệ chung của tiêu chảy (24% đối với nhánh SC so với 36% đối với nhánh IV), đau bụng và tiêu hóa (6% đối với nhánh SC so với 19% đối với nhánh IV), tình trạng suy nhược (27% đối với nhánh SC so với 39% đối với nhánh IV), nhiễm trùng đường hô hấp trên (14% SC nhánh so với 26% IV nhánh) và bệnh thần kinh ngoại vi NEC (38% SC nhánh so với 53% IV nhánh) thấp hơn 12-15% ở nhóm SC so với IV. nhóm. Ngoài ra,6% bệnh nhân được báo cáo có phản ứng cục bộ bất lợi với việc dùng SC, chủ yếu là mẩn đỏ. Chỉ 2 (1%) đối tượng được báo cáo là có phản ứng nghiêm trọng. Các phản ứng cục bộ nghiêm trọng này là 1 trường hợp ngứa và 1 trường hợp mẩn đỏ. Những phản ứng này hiếm khi dẫn đến thay đổi liều lượng và tất cả đều được giải quyết trong thời gian trung bình là 6 ngày.
-
Tóm tắt các thử nghiệm lâm sàng ở bệnh nhân đa u tủy chưa được điều trị trước đây : Bảng 19 mô tả dữ liệu an toàn từ 340 bệnh nhân đa u tủy chưa được điều trị trước đó đã dùng Bortezomib Pharmidea IV (1,3 mg / m 2 ) kết hợp với melphalan (9 mg / m 2 ) và prednisone (60 mg / m 2 ) trong một nghiên cứu giai đoạn 3 tương lai
-
Sự tái hoạt của virus Herpes Zoster: Các bác sĩ nên cân nhắc sử dụng thuốc dự phòng kháng virus ở những bệnh nhân đang được điều trị bằng Bortezomib Pharmidea. Trong nghiên cứu pha 3 ở những bệnh nhân đa u tủy chưa được điều trị trước đó, tỷ lệ tái hoạt động herpes zoster nói chung phổ biến hơn ở những bệnh nhân được điều trị bằng VcMP so với MP (tương ứng là 14% so với 4%). 26% bệnh nhân trong nhóm VcMP đã sử dụng dự phòng kháng vi-rút. Tỷ lệ mắc herpes zoster ở những bệnh nhân trong nhóm điều trị VcMP là 17% ở những bệnh nhân không được dùng thuốc dự phòng kháng vi-rút so với 3% ở những bệnh nhân được dùng thuốc dự phòng bằng thuốc kháng vi-rút.
-
Bệnh nhân bị u lympho tế bào lớp áo : Dữ liệu an toàn cho bệnh nhân bị u lympho tế bào lớp áo đã được đánh giá trong một nghiên cứu giai đoạn 2, bao gồm 155 bệnh nhân được điều trị bằng Bortezomib Pharmidea ở liều khuyến cáo 1,3 mg / m 2 . Hồ sơ an toàn của Bortezomib Pharmidea ở những bệnh nhân này tương tự như được quan sát ở bệnh nhân đa u tủy. Sự khác biệt đáng chú ý giữa 2 quần thể bệnh nhân là giảm tiểu cầu, giảm bạch cầu trung tính, thiếu máu, buồn nôn, nôn và sốt cao được báo cáo thường xuyên hơn ở những bệnh nhân đa u tủy so với những người bị u lympho tế bào lớp áo; trong khi bệnh thần kinh ngoại vi, phát ban và ngứa ở bệnh nhân u lympho tế bào lớp áo cao hơn so với bệnh nhân đa u tủy.
-
Các tần suất được cung cấp như sau phản ánh tỷ lệ báo cáo về các phản ứng có hại của thuốc từ trải nghiệm hậu tiếp thị trên toàn thế giới với Bortezomib Pharmidea. Các tần số được cung cấp phản ánh tỷ lệ báo cáo và không thể ước tính chính xác tỷ lệ mắc bệnh. Các phản ứng có hại của thuốc này được xếp hạng theo tần suất, theo quy ước sau: Rất phổ biến (≥1 / 10), phổ biến (≥1 / 100 và <1/10), không phổ biến (≥1 / 1.000 và <1/100), hiếm gặp (≥1 / 10.000 và <1 / 1.000), rất hiếm (<1 / 10.000, kể cả các báo cáo riêng biệt)
Tương tác thuốc Bortezomib Pharmidea
-
Các nghiên cứu in vitro và ex vivo trên động vật chỉ ra rằng Bortezomib Pharmidea là một chất ức chế yếu các isozyme cytochrome P-450 (CYP450) 1A2, 2C9, 2C19, 2D6 và 3A4. Dựa trên sự đóng góp hạn chế (7%) của CYP2D6 vào quá trình chuyển hóa của thuốc, kiểu hình của chất chuyển hóa kém CYP2D6 được cho là sẽ không ảnh hưởng đến việc xử lý tổng thể của Bortezomib Pharmidea.
-
Một nghiên cứu về tương tác thuốc – thuốc đánh giá ảnh hưởng của ketoconazole, một chất ức chế CYP3A4 mạnh, đối với dược động học của Bortezomib Pharmidea, cho thấy AUC của Bortezomib Pharmidea tăng 35%, dựa trên dữ liệu từ 12 bệnh nhân. Do đó, bệnh nhân nên được theo dõi chặt chẽ khi dùng Bortezomib Pharmidea kết hợp với các chất ức chế CYP3A4 mạnh (ví dụ, ketoconazole, ritonavir).
-
Trong một nghiên cứu tương tác thuốc – thuốc đánh giá ảnh hưởng của omeprazole, một chất ức chế mạnh CYP2C19, đối với dược động học của Bortezomib Pharmidea, không có ảnh hưởng đáng kể đến dược động học của Bortezomib Pharmidea dựa trên dữ liệu từ 17 bệnh nhân.
-
Một nghiên cứu về tương tác thuốc – thuốc đánh giá ảnh hưởng của rifampicin, một chất cảm ứng CYP3A4 mạnh, trên dược động học của Bortezomib Pharmidea cho thấy mức giảm AUC của Bortezomib Pharmidea trung bình là 45% dựa trên dữ liệu từ 6 bệnh nhân. Do đó, không khuyến cáo sử dụng đồng thời Bortezomib Pharmidea với chất cảm ứng CYP3A4 mạnh vì hiệu quả có thể bị giảm. Ví dụ về chất cảm ứng CYP3A4 là rifampicin, carbamazepine, phenytoin, phenobarbital và St. John’s wort. Trong cùng một nghiên cứu về tương tác thuốc-thuốc, tác dụng của dexamethasone, một chất cảm ứng CYP3A4 yếu hơn, đã được đánh giá. Không có ảnh hưởng đáng kể đến dược động học của Bortezomib Pharmidea dựa trên dữ liệu từ 7 bệnh nhân.
-
Một nghiên cứu tương tác thuốc – thuốc đánh giá tác dụng của melphalan-prednisone trên Bortezomib Pharmidea cho thấy AUC trung bình của Bortezomib Pharmidea tăng 17% dựa trên dữ liệu từ 21 bệnh nhân. Điều này không được coi là có liên quan về mặt lâm sàng.
-
Trong các thử nghiệm lâm sàng, tình trạng hạ đường huyết và tăng đường huyết đã được báo cáo ở những bệnh nhân đái tháo đường dùng thuốc hạ đường huyết dạng uống. Bệnh nhân đang điều trị bằng thuốc trị đái tháo đường uống Bortezomib Pharmidea có thể yêu cầu theo dõi chặt chẽ mức đường huyết và điều chỉnh liều lượng thuốc trị đái tháo đường của họ.
-
Bệnh nhân nên được thận trọng về việc sử dụng đồng thời các thuốc có thể liên quan đến bệnh thần kinh ngoại biên (ví dụ, amiodarone, thuốc kháng vi-rút, isoniazid, nitrofurantoin hoặc statin) hoặc làm giảm huyết áp.
-
Không tương thích: bortezomib Pharmidea không được trộn lẫn với các sản phẩm khác làm thuốc trừ nêu tại Phạt cảnh cáo đối Cách sử dụng: Hướng dẫn sử dụng, xử lý và Xử lý
Quên liều và cách xử trí
-
Ở những bệnh nhân quá liều nhiều hơn gấp đôi liều khuyến cáo có liên quan với sự khỏi đau cấp tính có
-
triệu chứng hạ huyết áp và giảm tiểu cầu với dẫn đến gây tử vong.
-
Không có thuốc giải độc đặc hiệu cho quá liều bortezomib. Trong các biến chứng quá liều, các dấu hiệu sinh tồn của bệnh nhân cần được theo dõi chặt chẽ và có các biện pháp chăm sóc hỗ trợ thích hợp để duy trì huyết áp (như truyền dịch, các chất gây tăng huyết áp và co bóp cơ tim) và nhiệt độ cơ thể.
Quá liều và cách xử trí
-
Không tiêm gấp đôi vào liều sau
Bảo quản
-
Nơi khô, dưới 30 độ C, tránh ánh sáng trực tiếp.
Hạn sử dụng
-
Thuốc có thời hạn sử dụng 36 tháng kể từ ngày sản xuất và được in trên bao bì thuốc
Quy cách đóng gói
-
Hộp 1 lọ
Nhà sản xuất
-
Sia Pharmidea Latvia
Sản phẩm tương tự
Câu hỏi thường gặp
Sản phẩm liên quan
Sản phẩm cùng hãng
Bình luận
Bạn hãy là người đầu tiên nhận xét về sản phẩm này